白皮书:
人工智能驱动的有机合成--走向自主合成之路?
改编自
C.Empel, R. M. Koenigs,Angew.Chem.Int.Ed. 2019,58, 17114. https://doi.org/10.1002/anie.201911062
由 Wiley 惠供出版。
几十年来,有机化学家们的创造力和一丝不苟的严谨态度使得复杂分子的有机合成成为可能,其合成通常被称为 "合成的艺术"。人工智能算法正在不断发展和完善,不仅可以进行文献检索和逆向合成分析,还可以对包括反应条件在内的潜在合成路线进行识别和排序。Embel 和 Koenigs 回顾了最近的一篇《科学》文章,该文章将人工智能 (AI) 驱动的小分子合成设计与人工智能开发的自动合成过程相结合。
引言
传统上,复杂分子(包括有机合成)的全合成涉及创造性、对每一步所需产品产率的细致评估,以及针对特定生化或生物特性(如生物利用度、溶解度)修改反应和优化产率的重复过程。人工智能正被用于提出反应方法,如合成化合物的新途径。Empel 和 Koenigs 认为,人工智能的下一步发展将是复杂分子的多步自动合成。自动合成和自主合成虽然相似,但在对人类输入的需求上有所不同。在自动合成过程中,需要人工在反应文件中定义阈值、边界、反应参数和合成协议。相比之下,自主合成是一种自我管理的合成过程,可根据立体选择性和反应产率等周围参数进行调整,无需人工输入。
。
传统逆向合成分析和自动合成的局限性
如果没有人工智能的支持,化学家很容易在迅速扩展的化学文献中错过新型底物的相关组合、反应优化、改进催化剂的设计和新型反应。化学科学的所有学科都认为小分子的化学合成是一个瓶颈,而按需自动合成有助于克服这一挑战。
溶解性差的化合物给自动化工作流程带来了额外的挑战,由于堵塞通道,往往需要更多的人工投入来改进流程。对拟议合成设计中反应物溶解度的预测仍然有限,这阻碍了某些合成路线的执行第18 条绿色。需要或产生亚环境温度的反应通常也需要化学家专家的建议,以保持高效的工作流程。自动合成后,需要对最终化合物进行批量纯化,可能需要特殊设备,如特定的色谱柱。
。
人工智能-合成途径的设计和自动化合成
Embel 和 Koenigs 总结了 Jamison 和 Jensen 及其同事最近发表的文章[1]。如图 1 所示,他们将计算机辅助的逆向合成设计与机器人可重新配置的流动装置相结合,按需合成小分子(50-750 克/摩尔)。该系统仍然需要人工输入,以便将人工智能合成算法与实际考虑因素(如精确的立体化学和溶剂选择)相结合,帮助优化多步合成过程。
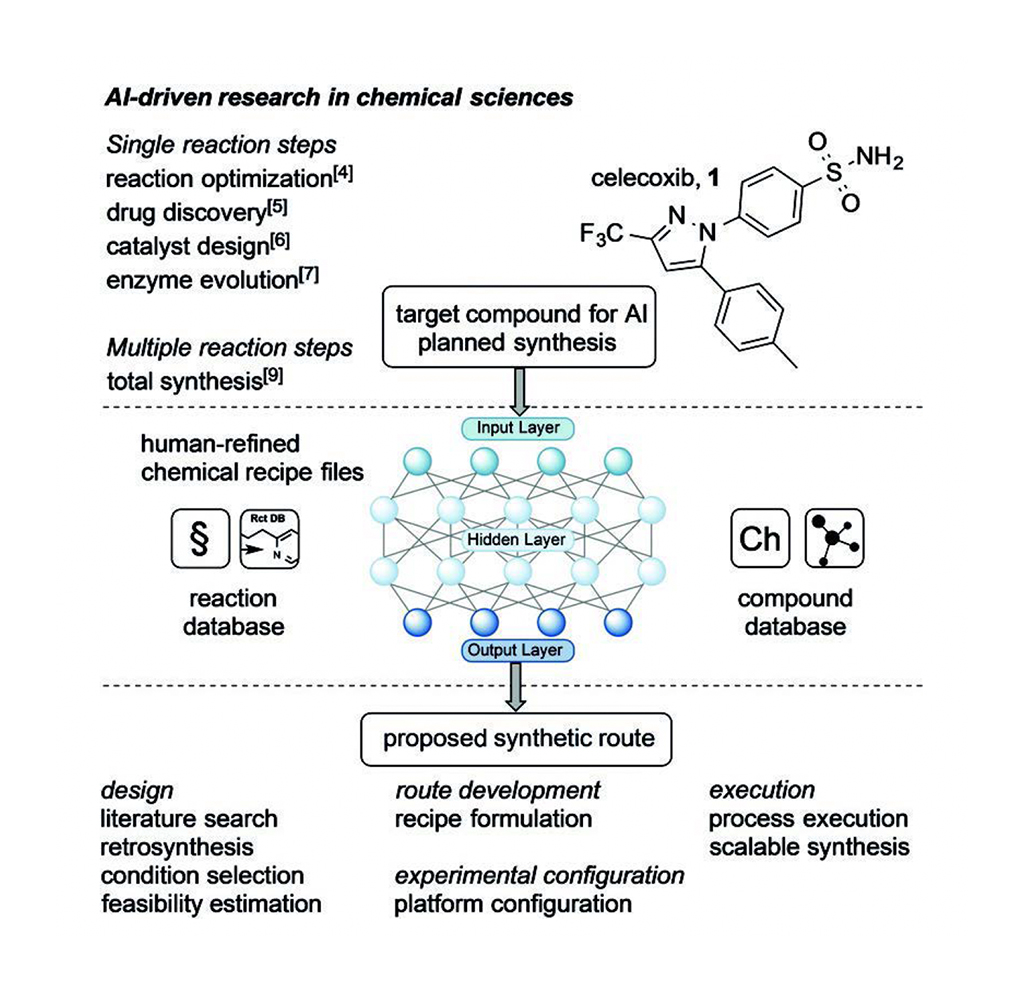
人工智能从包括逆合成反应和相关化合物反应的数据库文献检索中学习设计原则,从而设计出一条或多条合成路线。提出的计划包括每个步骤的反应条件、前体、酶(如需要)、催化剂、底物、前体和副产物。人工智能还对每个拟议合成计划的可行性进行评估,以便化学家选择最合适的自动化计划,通常是在微流体中进行,目的是扩大工艺规模。人工智能从反应和化合物数据库中开发出硅合成设计方案后,化学家利用他们的合成专业知识完善化学合成配方文件以及实验和平台配置。化学家们会调整配方文件,以克服微流体流动系统的任何不足之处,然后再将其用于自动化系统的化学区。因此,化学家的输入有助于机器人实施拟议的多步合成,这是向可扩展合成迈出的重要一步。
Jamison、Jensen及其同事利用这一策略预测了15种小分子的从头合成路线,修改了相关配方文件,并利用微流体工作流程实现了自动合成[1]。这 15 种化合物包括非甾体抗炎药(NSAID)塞来昔布、血液稀释剂华法林和 ACE 抑制剂原药奎那普利。图 2(上图)显示了非甾体抗炎药塞来昔布(结构 1)的合成过程。前两个机器人控制的反应槽进行了 4-甲基苯乙酮(2)与三氟乙酸甲酯(3)的克莱森缩合反应。另一个由机器人控制的反应舱进行了中间体与肼的最终缩合(4),并生成了塞来昔布。
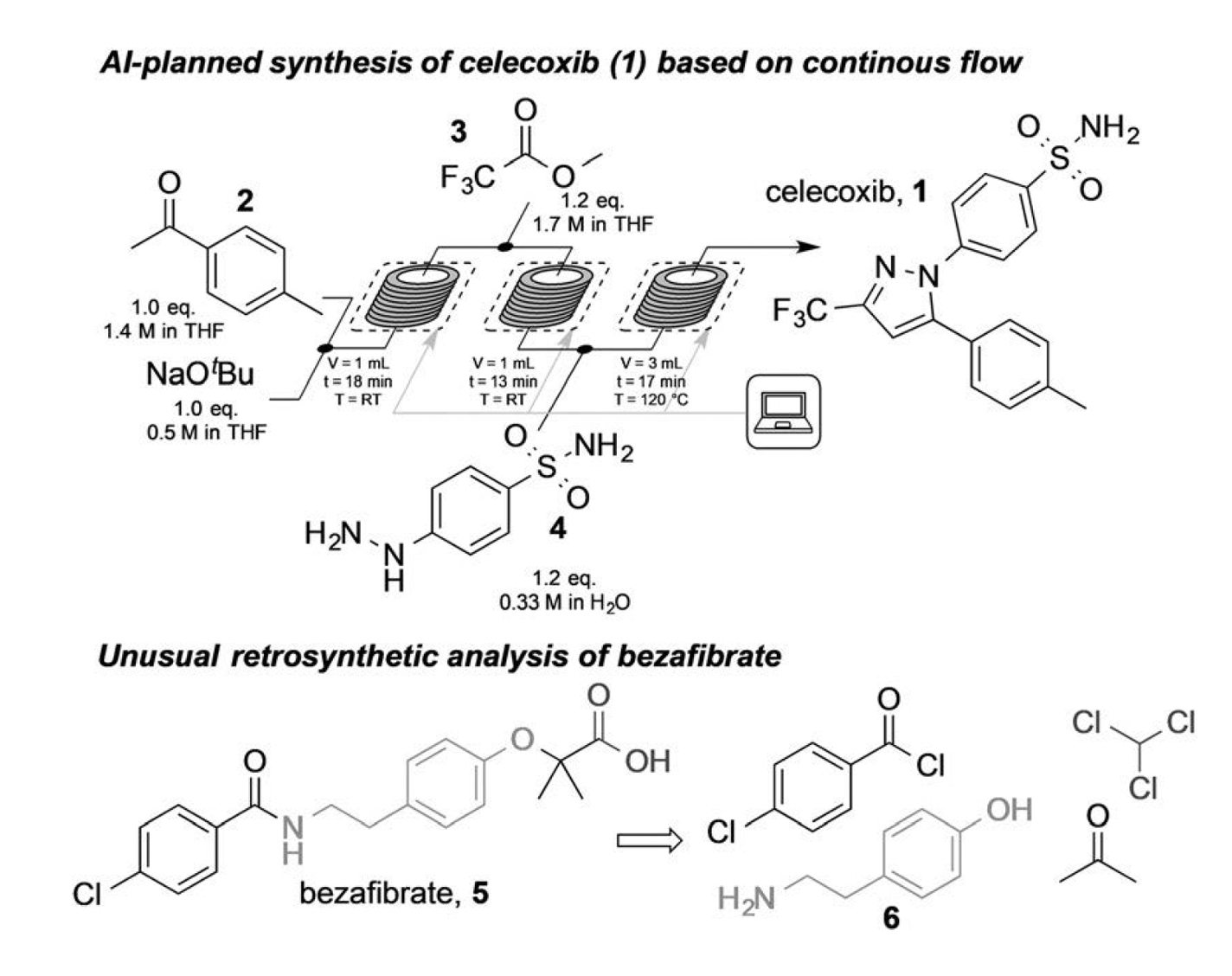
Jamison、Jensen及其同事应用人工智能驱动技术制定了多种ACE抑制剂和众多塞来昔布类似物的合成设计和合成执行[1]。小分子化合物的产量从 342 毫克/小时到 572 毫克/小时不等。
人工智能提出的贝扎贝特合成设计采用了涉及丙酮、氯仿和苯酚的巴盖里尼反应 (6)。然而,在尝试用微流体法合成贝扎贝特(图 2 复合物 5)的过程中出现了亚环境温度。Jamison、Jensen及其同事通过进行单独的人工合成过程,证明了人工智能提出的合成设计方案的可行性。其产量为 76%。
未来改进
多个研究小组正在努力改进人工智能驱动的立体化学分析和预测方法,以便在提议的合成中倾向于所需的立体化学结构。这种改进可以减少修改和使用化学配方文件所需的人工输入。
未来,人工智能还可能提出连续纯化方案或批量纯化系统,以提供相对纯净的目标化合物。增加在线反应分析功能可提供有关反应进展的重要信息,并允许反馈算法实时更改反应参数,从而有可能提高效率和产率。
摘要
Jamison、Jensen 及其同事介绍了他们通过将计算机辅助的逆合成设计与指导机器人可重构流动装置的化学精炼反应文件相结合,实现了人工智能驱动的小分子(50-750 克/摩尔)按需合成[1]。他们利用这一策略预测了 15 种小分子的从头合成路线,修改了相关配方文件,并利用微流体工作流程实现了自动合成。这 15 种化合物包括非甾体抗炎药(NSAID)塞来昔布、血液稀释剂华法林和 ACE 抑制剂原药奎那普利。Embel 和 Koenigs 讨论了一些限制因素,如一种或多种成分的溶解性较差以及目标化合物需要特定的立体化学结构。他们还建议扩大人工智能驱动的拟议计划,纳入纯化方案和/或过程中反应分析,以进一步实现合成过程的自动化。这些改进将把常规合成和优化工作分流给机器人,这样化学家就可以把更多精力用于好奇心驱动的研究项目、全面的反应监控和分析以及偶然的发现。
。
参考文献
[1] Coley, C.W.et al. (2019).A roboticplatform for flow synthesis of organic compounds informed by AI planning.Science.DOI: 10.1126/science.aax1566.
