白書
人工知能主導の有機合成-自律合成への道?
C.より引用。Empel, R. M. Koenigs,Angew.Chem.Int.Ed. 2019,58, 17114. https://doi.org/10.1002/anie.201911062
Wileyの好意により掲載。
有機化学者の創造性と綿密な規律は、数十年にわたり複雑な分子の有機合成を可能にしており、その合成はしばしば "合成の芸術 "と呼ばれている。人工知能アルゴリズムは、文献検索や逆合成分析を行うだけでなく、反応条件を含む潜在的な合成ルートを特定し、ランク付けするために開発され、改良されている。EmbelとKoenigsは、人工知能(AI)が主導する低分子の合成計画開発と、AIが開発した自動合成プロセスを組み合わせた最近のScience誌の論文をレビューしている。彼らはまた、その限界について議論し、AI主導の有機合成アウトプットの利点を高めるための将来の革新に注目している。
はじめに
従来、有機合成を含む複雑な分子の全合成には、創造性、所望の生成物の収率を得るための各ステップの綿密な評価、特定の生化学的または生物学的特性(生物学的利用能、溶解度など)に合わせて反応を修正し収率を最適化するための反復プロセスが必要であった。AIは、化合物合成のための新しい経路などの反応方法論の提案に利用されている。EmpelとKoenigsは、AIの次の進化段階として、複雑な分子の自動多段階合成を提案している。自動合成と自律合成は似ているが、人間の入力が必要な点で異なる。自動合成では、反応ファイルに閾値、境界、反応パラメーター、合成プロトコルを定義するために人間の入力が必要である。それに比べ、自律合成は、立体選択性や反応収率といった周囲のパラメータを、人間の入力なしに調整する自己制御型の合成プロセスである。
従来の逆合成分析と自動合成の限界
AIのサポートがなければ、化学者は新規基質の適切な組み合わせ、反応の最適化、改良された触媒の設計、急速に拡大する化学文献の中の新規反応を簡単に見逃してしまう。化学合成のどの分野でも、低分子の合成はボトルネックであり、自動オンデマンド合成はこの課題を克服するのに役立つ。
溶解性の低い化合物は、自動ワークフローに余分な課題をもたらし、チャンネルが詰まるため、プロセス改善のために多くの人手を必要とすることが多い。提案された合成計画における反応物の溶解度に関する予測は依然として限られており、これがいくつかの合成経路の実行を妨げている。 効率的なワークフローを維持するためには、通常、常温以下の温度を必要とする反応や、常温以下の温度をもたらす反応には、専門家である化学者のアドバイスが必要である。自動合成後、最終化合物のバッチ精製が必要となり、特殊なカラムなど特別な装置が必要となる場合がある。
AI-合成経路の計画と自動合成
EmbelとKoenigsは、JamisonとJensenらによる最近の論文[1]を要約している。彼らは、図1に要約したように、低分子(50-750g/モル)のオンデマンド合成を提供するために、コンピュータ支援による逆合成計画とロボットによる再構成可能なフロー装置を組み合わせた。このシステムは、多段階合成プロセスを最適化するのに役立つ実用的な考察(例えば、正確な立体化学や溶媒の選択)とAI合成アルゴリズムを補完するために、依然として人間の入力を必要とする。
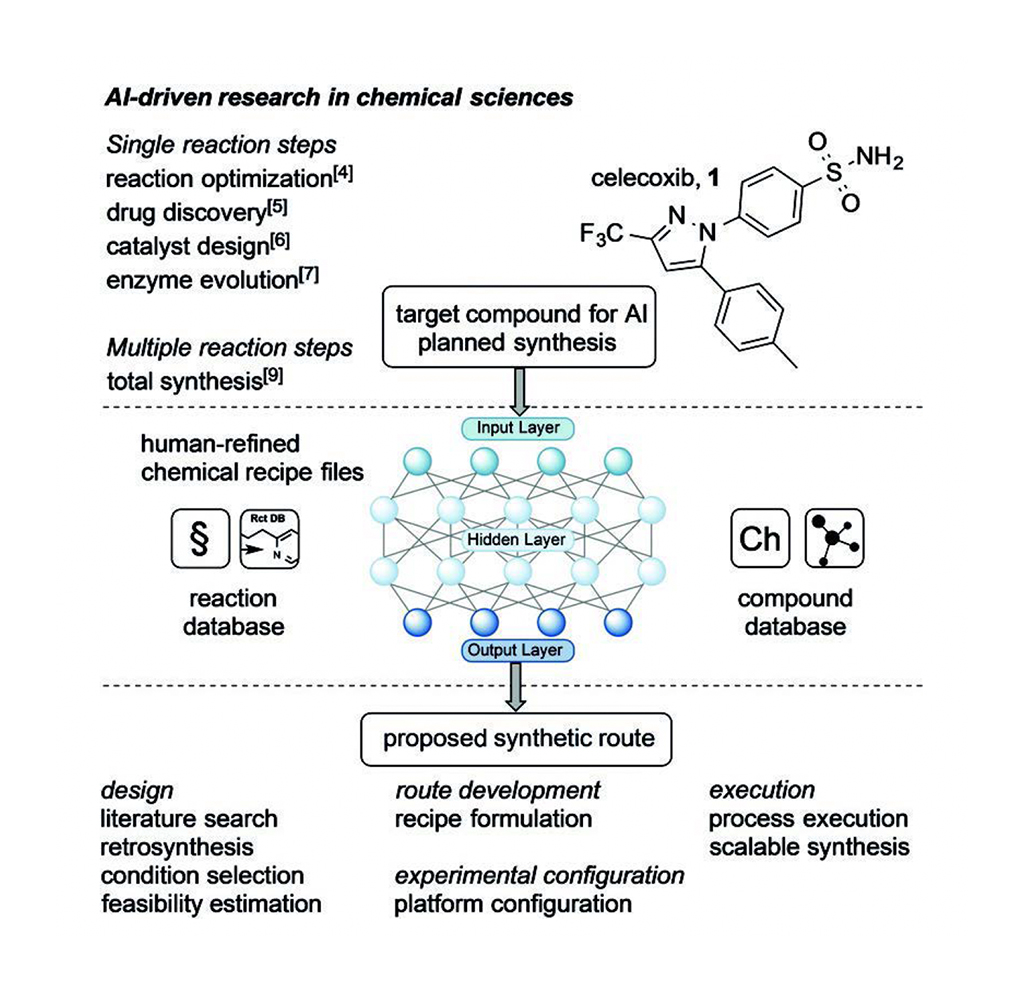
AIは、逆合成反応や関連化合物反応を含むデータベースの文献検索から設計原理を学習し、1つ以上の合成経路を設計する。提案される計画には、各段階における反応条件、前駆体、酵素(必要に応じて)、触媒、基質、前駆体、副生成物が含まれる。AIはまた、提案された各合成計画の実現可能性の見積もりも提供するため、化学者は、プロセスのスケールアップを意図した自動化(多くの場合、マイクロ流体での自動化)に最適な計画を選択することができる。AIが反応データベースと化合物データベースからin silico合成計画を開発した後、化学者は合成の専門知識を駆使して化学レシピファイルと実験およびプラットフォーム構成を改良する。化学者は、自動化システムのケミカルベイで使用される前に、マイクロ流体フローシステムの不備を克服するためにレシピファイルを調整する。このように、化学者の入力は、提案された多段階合成のロボットによる実施を容易にし、スケーラブルな合成への大きな一歩となる。
Jamison、Jensenたちはこの戦略を使って、15種類の低分子のde novo合成経路を予測し、関連するレシピファイルを修正し、マイクロ流体ワークフローを使って合成を自動化した[1]。15種類の化合物には、非ステロイド性抗炎症薬(NSAID)のセレコキシブ、血液サラサラ薬のワーファリン、ACE阻害剤のプロドラッグであるキナプリルが含まれる。図2(上段)は、非ステロイド性抗炎症薬(NSAID)セレコキシブ(構造1)の合成過程を示している。最初の2つのロボット制御反応ベイは、4-メチルアセトフェノン(2)とトリフルオロ酢酸メチル(3)のクライゼン縮合を行った。もう一つのロボット制御反応ベイは、中間体とヒドラジンとの最終縮合を行い(4)、セレコキシブを得た。
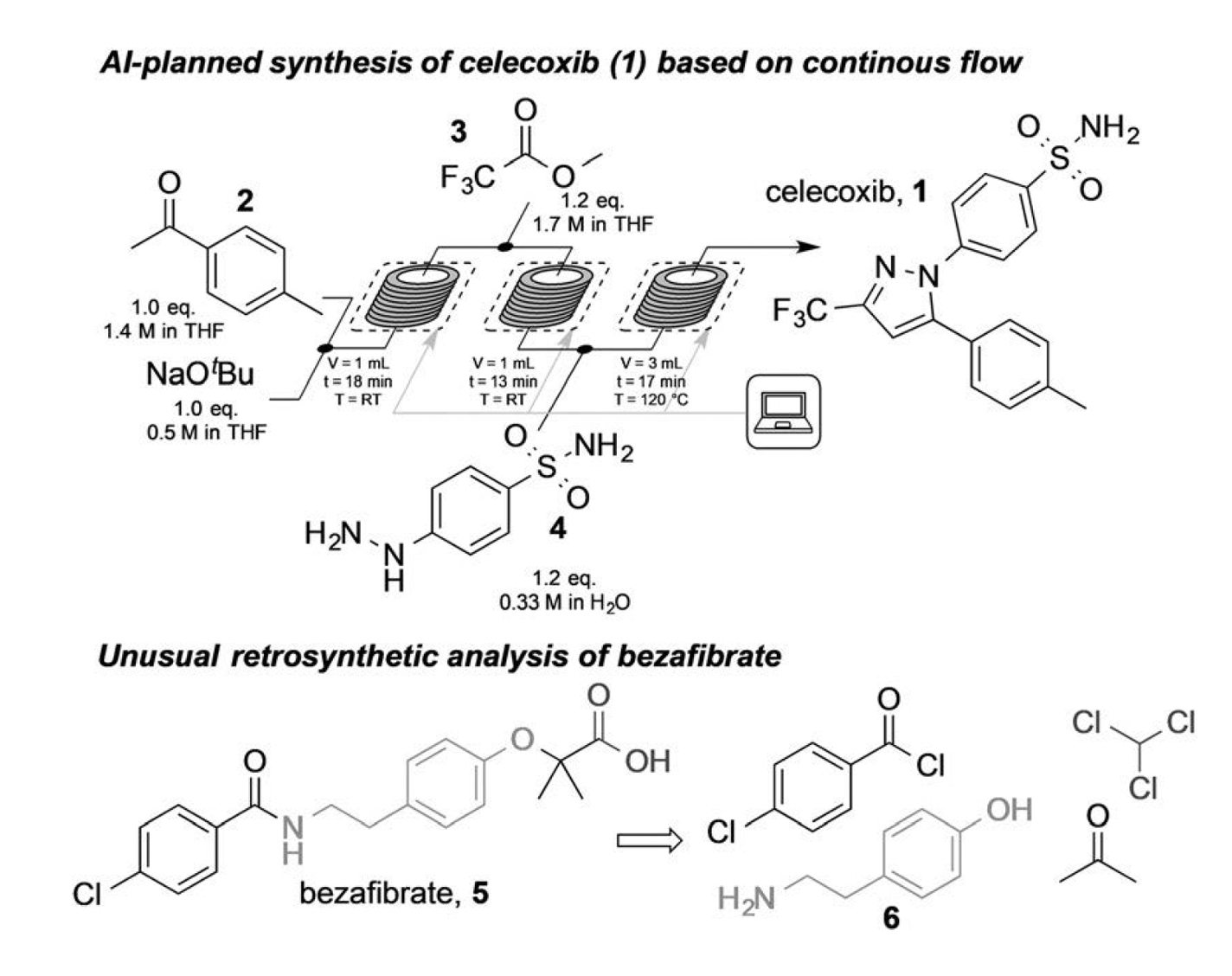
Jamison、Jensenらは、AI駆動技術を応用して、複数のACE阻害剤と多数のセレコキシブ類似体の合成計画を立て、合成を実行した[1]。低分子の収率は342 mg/hから572 mg/hであった。
AIが提案したベザフィブラートの合成計画では、アセトン、クロロホルム、フェノールを含むバルゲリーニ反応を用いた(6)。しかし、マイクロ流体によるベザフィブラート(図2化合物5)の合成を試みたところ、常温以下の温度が発生した。Jamison、Jensenらは、別の手動合成工程を行うことにより、AIが提案した合成計画の実現可能性を実証した。その収率は76%であった。
今後の改善
複数のグループが、AIによる立体化学の分析と予測、および提案された合成において望ましい立体化学構造を優先する方法の改善に取り組んでいる。この改良により、化学的レシピファイルの修正と使用に必要な人的入力が削減される可能性がある。
将来、AIはまた、比較的純粋な標的化合物を提供するために、連続精製スキームまたはバッチ精製システムを提案できるようになるかもしれない。オンライン反応解析を追加することで、反応進行に関する重要な情報を提供し、フィードバックアルゴリズムがリアルタイムで反応パラメーターを変更し、効率と収率を改善できる可能性がある。
。
まとめ
Jamison、Jensenらは、コンピュータ支援による逆合成計画と、ロボットによる再構成可能なフロー装置を指示する化学者精製反応ファイルを組み合わせた、低分子(50-750g/モル)のAI駆動型オンデマンド合成について述べた[1]。彼らはこの戦略を使って、15種類の低分子のde novo合成ルートを予測し、関連するレシピファイルを修正し、マイクロ流体ワークフローを使って合成を自動化した。15種類の化合物には、非ステロイド性抗炎症薬(NSAID)セレコキシブ、血液サラサラ薬のワーファリン、ACE阻害剤のプロドラッグであるキナプリルなどが含まれる。EmbelとKoenigsは、1つまたは複数の成分の溶解性の低さや、特定の立体化学を必要とする標的化合物などの限界について議論した。彼らはまた、AI主導で提案された計画を拡大し、精製スキームや、あるいは合成プロセスをさらに自動化するためのインプロセス反応解析を含めることを提案した。これらの改善により、日常的な合成と最適化作業をロボットに振り向けることができ、化学者は好奇心主導の研究プロジェクト、徹底的な反応のモニタリングと分析、セレンディピティな発見により多くの労力を費やすことができる。
。
参考文献
[1] Coley, C.W.et al. A roboticplatform for flow synthesis of organic compounds informed by AI planning.Science.DOI: 10.1126/science.aax1566.
.
